
紫甘蓝是一种常见的食材,其汁液中的花青素,是一种天然的水溶性色素,可以抗氧化,清除体内自由基,延缓衰老。
更吸引我们的是它丰富多彩的颜色,这不,疫情期间我们用它开启了科普课堂,在家里制备了紫甘蓝酸碱指示剂。

酸碱指示剂的变色反应,在很多人心里是“化学实验”的招牌,最早是由英国年轻的科学家罗伯特·波义耳发现的。早在17世纪的某一天,波义耳将紫罗兰花带入实验室,不小心将盐酸撒到花瓣上从而导致花瓣颜色变红,他感到新奇且兴奋,于是又对多种花草做了研究。

波义耳发现有一部分花草受酸或碱作用均能改变颜色,其中以石蕊地衣中提取的紫色浸液最明显,它遇酸变成红色,遇碱变变成蓝色。利用这一特点,他用石蕊浸液把纸浸透,然后烤干,这就制成了实验中常用的酸碱试纸——石蕊试纸。
1.变色原理
酸碱指示剂一般是有机弱酸或弱碱,他们的共轭酸碱对显示不同的颜色。酸性介质中,指示剂结合质子,以共轭酸形式存在,显酸色;在碱性介质中,以共轭碱形式存在,显碱色。

在实验室中经常用到的酸碱指示剂有石蕊、甲基橙、甲基红、酚酞、百里酚蓝、溴百里酚蓝等。
不同的酸碱指示剂具有特定的变色范围,使用时需根据体系需求选择合适的指示剂。
例如,测定用盐酸滴定碳酸钠和碳酸氢钠的混合物时,第一步CO32-转变为HCO3-,此时pH约为8.5,选用酚酞(变色范围8.0~10.0)做指示剂;第二步HCO3-转变为H2CO3,此时pH约为4,则需选用甲基橙(变色范围3.1~4.4)做指示剂。
单一指示剂变色范围一般都比较宽,在变色过程中还可能出现难以辨别的过渡色。为了达到一定的准确度,将滴定终点限制在较窄小的pH范围内(例如对弱酸和弱碱的滴定),可采用混合指示剂。
混合指示剂可分为两大类:一类是在某种指示剂中加入一种惰性染料,后者颜色并不随pH变化,因其颜色与指示剂互补使变色明显,变色范围不变。如甲基橙(0.1%)和靛蓝二磺酸钠(0.25%)组成的混合指示剂(1:1),靛蓝二磺酸钠在滴定过程中不变色,只作为甲基橙变色的背景。滴定过程中随着溶液pH变化,由黄绿色(或紫色)变化为紫色(黄绿色),中间呈近乎无色的浅灰色,变色敏锐,易于辨别。
另一类是由两种酸碱指示剂混合而成,彼此颜色互补、变色范围有重叠,混合使用使变色范围收紧,且颜色变化更敏锐。如溴甲酚绿(0.1%乙醇溶液)和甲基红(0.2%乙醇溶液)组成的混合指示剂(3:1),pH=5.1时,由于绿色和橙色相互迭合,溶液呈灰色,颜色变化十分明显,使变色范围缩小为变色点。
2.简单实用的pH试纸
要测溶液的酸碱度,最简便的方法便是利用pH试纸。目前,pH试纸分为广泛pH试纸和精密pH试纸。
广泛pH试纸上有甲基红、溴甲酚绿、百里酚蓝三种指示剂,测量范围为1-14,能够大致测量溶液的酸碱性;而精密pH试纸可以将pH值精确到小数点后一位,按照测量精度可分为0.5级、0.3级、0.2级或更高精度。
在使用pH试纸测溶液的酸碱度时,应用玻璃棒蘸取少量液体滴到试纸上,试纸不可直接伸入溶液;不能在测定前用蒸馏水润湿,这样会导致测量不准确;必须在常温下使用,过高温度和过低温度均会影响结果的准确度。

ps:某些试纸使用说明给出了错误的指示,大家要坚持操作规范哦!

某些试纸背后错误的使用说明
3.pH测试神器—pH计
在化工、医药、教学科研、环保等领域的科研工作中,经常需要测得更精密的pH值。比如,正常人体血液pH 值为 7.35~7.45,变化范围只有0.1个pH单位,在诊断患者是否发生酸碱中毒的问题时,需要准确测量患者血液的pH值,误差稍大就可能造成误诊或漏诊,这时候pH计就显示了它的强大威力。
pH计又称酸度计,是采用电位分析法测量溶液 pH值的仪器,由参比电极、指示电极及精电位计三部分组成。将指示电极和参比电极插入被测溶液中,组成一个电化学电池,其中参比电位在一定温度下是定值,指示电极电位随pH 值变化而变化,电位计测得的电动势也就随pH 值变化而变化了。将电动势的值折算成溶液的pH 值,显示在仪表面板上,测量者就可以直接读数啦。
根据不同需要,可以选择不同类型的pH计。笔试与便携式酸度计可由检测人员带到现场检测使用,而高校实验室一般使用测量范围广、功能多、测量精度高的台式pH计。
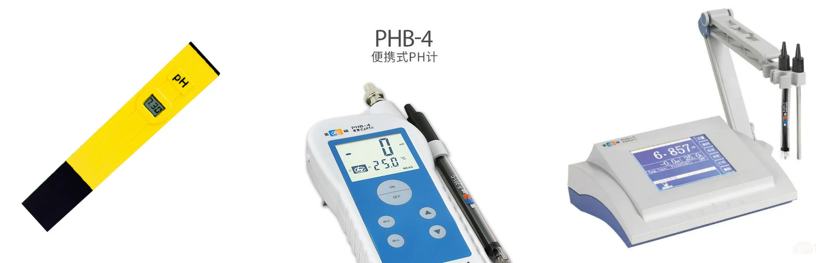
pH计按测量精度可分0.2级、0.1级、0.01级、0.001级,指的是分度值或最小显示值(pH)0.2、0.1、0.01、0.001。但仪器级别与其准确度并不完全一致,除了电位计的精度,玻璃电极和参比电极对测量的准确度影响更大。
由于玻璃电极的系统误差和参比电极的溶液接界电势稳定性造成的误差都不小于0.01pH,因此,电位计的分辨率再高,仪器测试准确度都不会优于0.01pH。
4.pH计的使用和维护
目前广为使用的pH计电极是复合电极,即把玻璃电极和参比电极组合在一起。其优点是使用方便,不受氧化性或还原性物质的影响,而且平衡速度也比较快。
在进行操作前,应首先检查电极的完好性。首先检查玻璃球泡是否有裂痕、破碎,确认没有后,用pH缓冲溶液进行两点标定,若定位与斜率按钮均可调节到对应的pH值,即认为可以使用,否则可按使用说明书进行电极活化处理。
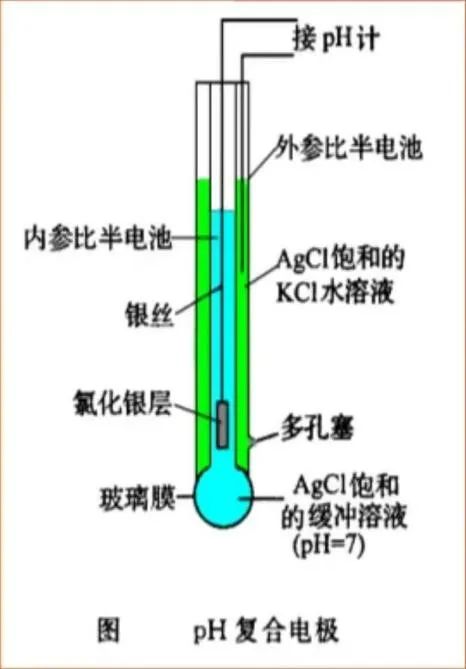
pH计的校准是确保测定结果准确性的关键步骤。尽管pH计种类很多,但均采用两点校准法。
选择两种标准缓冲液,一种是pH=7标准缓冲液,另一种是pH=9标准缓冲液或pH=4标准缓冲液,先用pH=7标准缓冲液对电计进行定位,再根据待测溶液的酸碱性选择第二种标准缓冲液,如果待测溶液呈酸性,则选用pH=4标准缓冲液,如果待测溶液呈碱性,则选用pH=9标准缓冲液。
若是手动调节的pH计,应在两种标准缓冲液之间反复操作几次,直至不需再调节其零点和定位(斜率)旋钮,pH计也可准确显示两种标准缓冲液pH值,则校准过程结束。此后,在测量过程中零点和定位旋钮就不应再动,若是智能式pH计,则不需反复调节,因为其内部已贮存几种标准缓冲液的pH值可供选择,而且可以自动识别并自动校准。

由于标准缓冲溶液的pH值与温度有关,所以校准时应特别注意待测溶液的温度,使其尽可能与标准缓冲溶液温度接近,并调节电计面板上的温度补偿旋钮,使其与待测溶液的温度一致。
校准结束后即可开始测定。使用时,将电极由电极保护帽内取出,用蒸馏水冲洗电极,用滤纸吸干。不能用滤纸擦拭电极头部的敏感玻璃膜,避免损坏。将电极放入待测样品中(电极头完全浸没在待测液体中),轻轻摇动样品(切勿将电极用作搅拌器),显示稳定后读数。测量完毕,先将电极由样品中取出,用蒸馏水冲洗电极,用滤纸吸干后插入电机保护帽内,竖直悬于支架上。
复合电极不用时应充分浸泡在3 mol/L 氯化钾溶液中,切忌用洗涤液或其他吸水性试剂浸洗。一定注意,电极是不能用于强酸、强碱或其他腐蚀性溶液酸碱度的测定的,并且严禁在脱水性介质如无水乙醇、重铬酸钾等中使用。
酸碱性是物质的基本性质,日常生活中我们也会接触到各种溶液,它们的酸碱性如何呢?快跟小温老师一起动手测一下吧!

编辑:祁雪
供稿:温志慧 邱晓航
视频制作:温志慧
图片来源:网络

